Was bedeutet die periode im periodensystem
Die ersten Chemiker, die das erkannten, waren Lothar Meyer und Dmitri Mendelejew.
Siehe auch
Kategorie: Stoffgruppe
Was ist das Periodensystem? Die Zahl ordnet die Elemente, deshalb heißt sie Ordnungszahl. Ab der 4. Die Perioden stehen in einem Zusammenhang mit den Elektronen.
Die Elektronen in der Hülle bewegen sich auf sogenannten Schalen um den Kern.
Elemente der 3. In jeder Zeile zählst du die Ordnungszahl du von links nach rechts immer eins höher. Wie du siehst, hat sein Atom neben dem Atomkern zwei Schalen.
Die ersten beiden Elektronen befinden sich in der ersten, inneren Schale.
Periode die 14 Actinoide. (p-Schale)
Die sechste Periode (p-Schale) folgt dem Muster der vorigen Perioden durch die Auffüllung der 6s- (Cs und Ba), 5d- (La), 4f- (Lanthanoide), 5d- (Hf–Hg) und 6p-Unterschalen (Tl–Rn).
7.
Jedoch passt das dritte Elektron nicht mehr in die erste Schale, weshalb eine zweite Schale notwendig ist.
In unserem Beitrag zum Schalenmodell findest du genauere Informationen. Periode (einschließlich) kommen noch jeweils zehn Nebengruppenelemente hinzu, bei denen die Anzahl der Elektronen der äußeren Schale zumeist zwei beträgt, und statt der äußeren die nächstinnere Elektronenschale aufgefüllt wird.
Denn die gleiche Anzahl positiver und negativer Ladungen hebt sich auf.
Die Größe der Atome steigt mit höherer Ordnungszahl. Deswegen nennst du die Ordnungszahl auch Kernladungszahl. Du kannst dir merken, dass die Periode, in der ein Element steht, der Anzahl der Schalen entspricht. Zusätzlich zeigen die Spalten die verschiedenen Gruppen.
Perioden
(02:54)
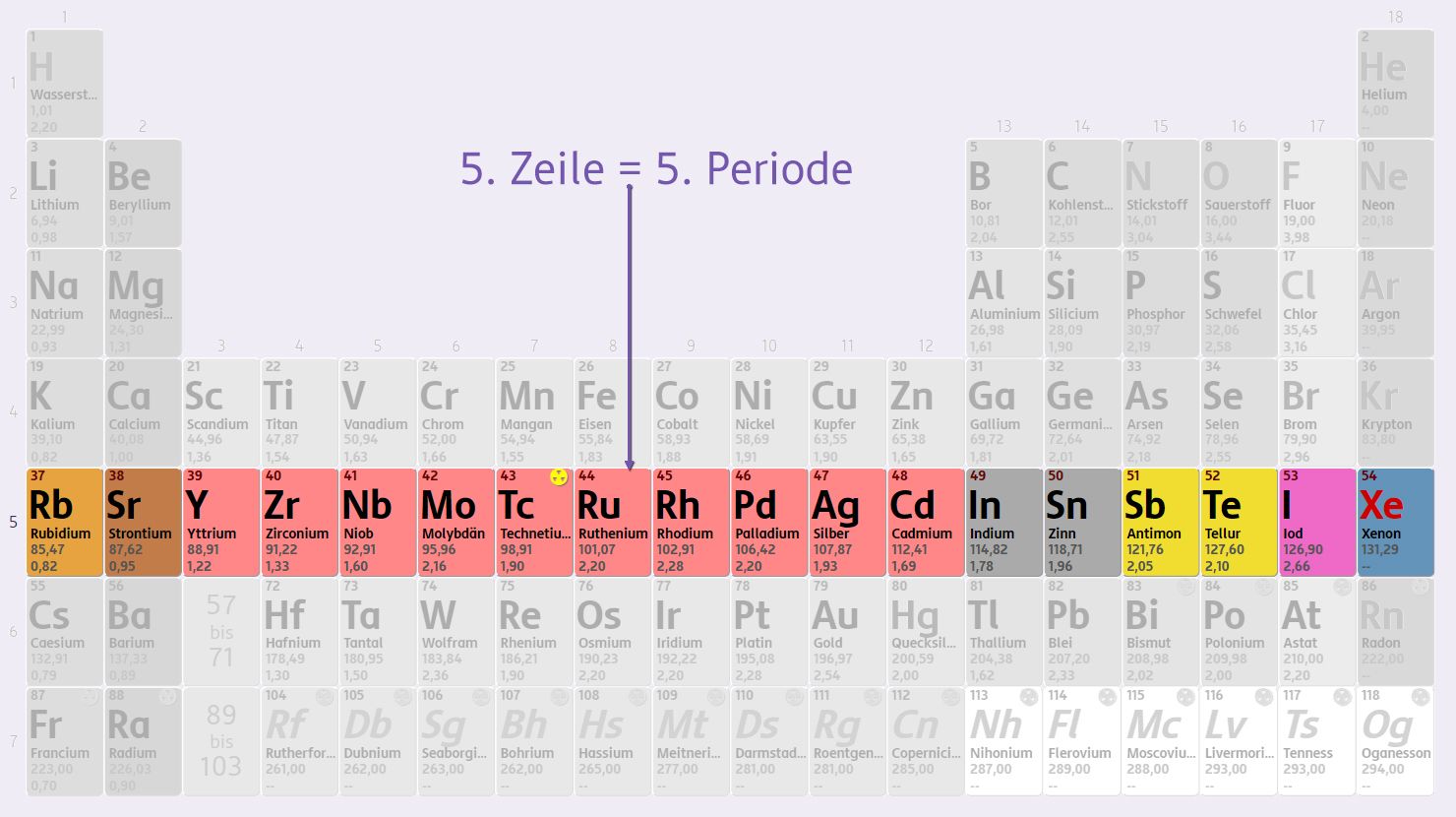
Du zählst die Perioden im PSE von oben nach unten.
Die Periode wird als Zeile im Periodensystem dargestellt und umfasst die Elemente, die die selbe Anzahl von Schalen in der Elektronenhülle besitzen.
Bis auf die erste Periode, die nur die Elemente Wasserstoff und Helium enthält, umfasst jede Periode acht Hauptgruppenelemente. Somit bestimmt sie die Position eines Elements.
direkt ins Video springen
Das Periodensystem beginnt links oben (Wasserstoff).
Quiz zum Thema Periodensystem Erklärung
5 Fragen beantworten
Periodensystem Erklärung im Detail
Du kennst nun die Grundlagen des Periodensystems und weißt, welche Informationen der chemischen Elemente du daraus ablesen kannst. Periode enthält zusätzlich noch die 14 Lanthanoide (auch seltene Erden genannt), die 7.

Je mehr Elektronen ein Atom hat, desto mehr Schalen braucht es, um die Elektronen zu verteilen.
Periode des Periodensystems
Das Periodensystem der Elemente ist in Perioden und Gruppen gegliedert. Das kannst du dir mit folgender Aussage einfacher merken.
Merke: Im Periodensystem stehen die kleinen Atome am Anfang und die großen am Ende.
Perioden und Gruppen
Das Periodensystem besteht aus Perioden und Gruppen, in welche die Elemente eingeordnet sind.
Das zeigen wir dir am Beispiel des Elements Lithium (Li).
direkt ins Video springen
- Lithium hat die Ordnungszahl 3. Beispiele für chemische Elemente sind:
- Aluminium (Al)
- Sauerstoff (O)
Die Reihenfolge der Elemente im Periodensystem ist durch eine bestimmte Zahl festgelegt.

Dabei stammen die Namen aus den Eigenschaften ihrer jeweiligen Elemente.
Die Halogene (Gruppe 17: F, Cl, Br, I) beispielsweise bilden mit Metallen der ersten und zweiten Hauptgruppe gerne ionische Verbindungen, also Salze . (k-Schale)
Das einzige Orbital der s-Unterschale kann maximal zwei Elektronen aufnehmen; die erste Periode (k-Schale) wird durch Wasserstoff (1 Elektron) und Helium (2 Elektronen) erschöpft.
2.
Jedes Element besitzt seine eigene Elementkarte, welche die Informationen zu den Eigenschaften beinhaltet. Die Atomradien nehmen ab, die Elektronegativität nimmt zu. Denn sie ist gleich der Anzahl der Protonen im Atomkern. Sie legten im 19. Aus dem Griechischen übersetzt bedeutet Halogene „Salzbildner“.
Elementkarte
Wie du siehst, sind die Elemente im Periodensystem in Kästchen eingeteilt.
Auch die Nebengruppenelemente sind allesamt Metalle, mit zum Teil ähnlichen Eigenschaften. Nach der geringsten benötigten Energie erfolgt die Besetzung der 4s- (K und Ca), 3d- (Sc–Zn) und daran anschließend 4d-Orbitale (Ga–Kr).
5. Periode sind Natrium (11 Elektronen) bis Argon (18 Elektronen).
4.
Innerhalb einer Periode steigt die Kernladungszahl, also die Anzahl der Protonen im Kern von links nach rechts.