Proteinogene aminosäuren strukturformel
Hier ist die OH-Gruppe in der Seitenkette durch eine SH-Gruppe ausgetauscht.

Während die Aminogruppe als Protonenakzeptor wirkt und Protonen aufnimmt, gibt die Carboxylgruppe als Protonendonator Protonen ab.Bei welchem pH-Wert eine Aminosäure als Zwitterion vorliegt, gibt der isoelektrische Punkt (IEP) an. Zwei ungewöhnliche Aminosäuren
Die Aminosäuren Prolin und Selenocystein
Autor: Ulrich Helmich 02/2024, Lizenz: Public domain
Die Aminosäure Prolin lässt sich nur ganz schwer einordnen.
B. Serin) und Säureamid-Gruppen (Asparagin, Glutamin). Beim Menschen gehören zu den nicht-proteinogenen AS u.a. unterlegt:
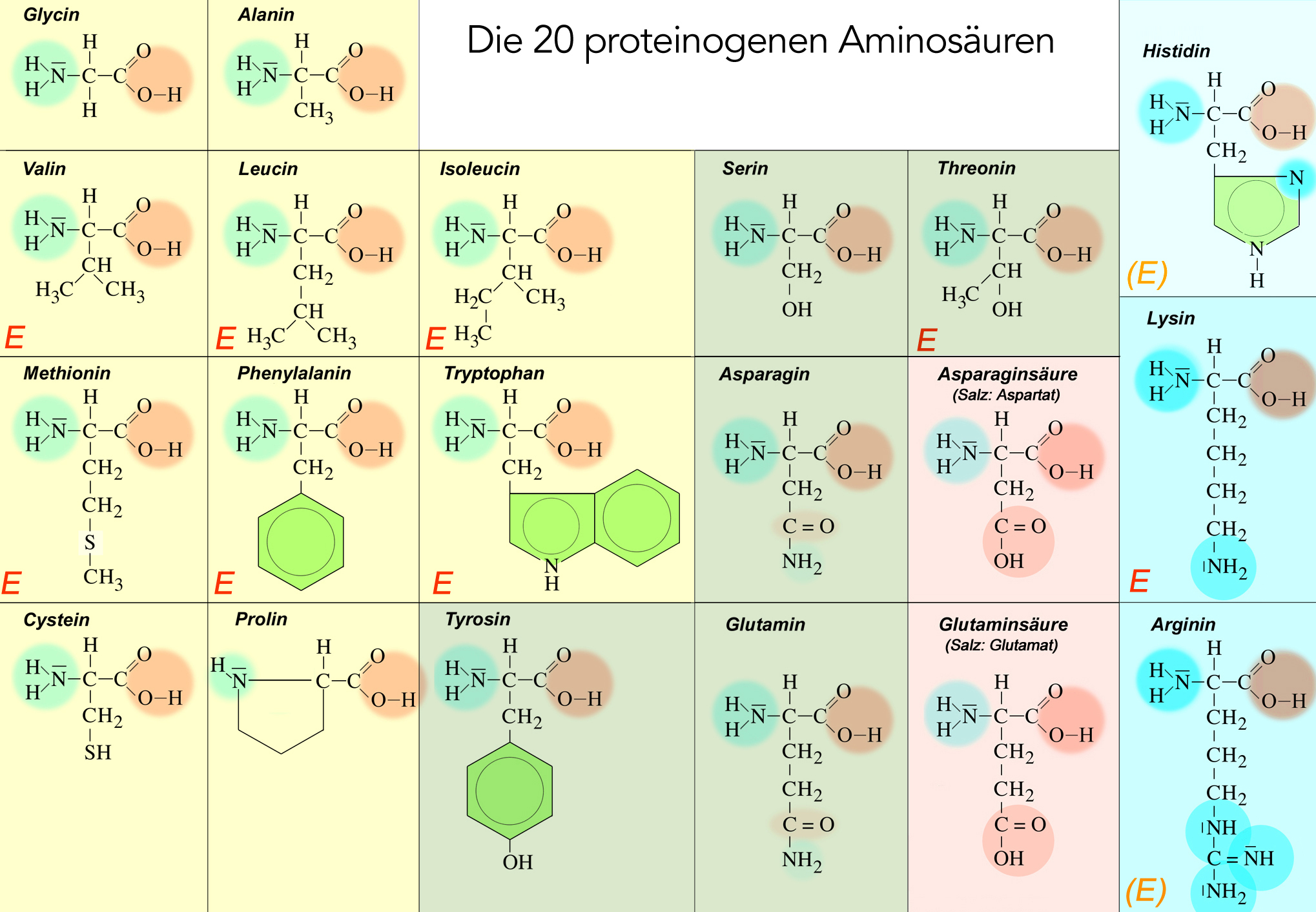
- Gelb = ungeladene unpolare Aminosäuren
- Grün = ungeladene polare Aminosäuren
- Rot = negativ geladene saure Aminosäuren
- Blau = positiv geladene basische Aminosäuren (Histidin hellblau, da kaum basisch)
Die negativen bzw.
Die Aminosäuren sind in reinem Zustand farblose kristalline Stoffe, die in festem Zustand überwiegend als Zwitterionen vorliegen[1].
Aminosäuren
Wer sich zunächst einen Überblick über den Aufbau und die Eigenschaften der 20 proteinogenen Aminosäuren verschaffen möchte, geht bitte auf die Seite Aminosäuren in dem Chemie-Lexikon auf dieser Homepage.
Hier werden dann grundlegende Begriffe wie Aminogruppe, Carboxygruppe, Säure/Base-Begriff etc.
Mit Ausnahme der Aminosäure Glycin ist das α-C-Atom bei allen Aminosäure asymmetrisch substituiert. Insgesamt besitzt der Mensch 20 proteinbildende Aminosäuren (proteinogene Aminosäuren).
Dieses Projekt ist über die Jahre weiter gewachsen.
Auf diesem Bild sind die 20 Aminosäuren farbig nach der Einteilung von Römpp, Alberts etc. eine 100 mal schwächere Base.
Histidin, eine Aminosäure, die bei Punkt 7 näher beschrieben wird, gehört nach Alberts [4] ebenfalls zu den basischen Aminosäuren.

Die Abbauprodukte glucogener Aminosäuren, können zur Gluconeogenese verwendet werden. direkt ins Video springen
- Polare neutrale Aminosäuren besitzen in der Seitenkette auch funktionelle Gruppen. Wegen der möglichen Protonen-Abgabe durch die Carboxygruppe werden diese Aminosäuren auch als saure Aminosäuren bezeichnet.
direkt ins Video springen
- UnpolarehydrophobeAminosäuren besitzen meistens eine lange Kohlenstoffkette, wie beispielsweise einen Phenylrest (z.B. Wenn ein Lebewesen diese Aminosäure benötigt, wird dazu das Stopcodon UGA quasi umprogrammiert.
Trotzdem erfüllen sie wichtige Funktionen im Organismus und sind an verschiedenen metabolischen Vorgängen beteiligt. Genau wie die Disulfidbrücken stabilisieren solche Ionenbindungen zwischen Aminosäure-Resten die Tertiärstruktur bzw. Die nicht-essentiellen Aminosäuren können vom Organismus selbst synthetisiert werden, während die essentiellen Aminosäuren aus externen Quellen – vor allem durch Nahrungsaufnahme – zugeführt werden müssen.
1806 fanden die französischen Forscher Vauquelin und Robiquet die Aminosäure beim Eindampfen von Spargelsaft.
Lysin und Arginin können Ionenbindungen bilden
Eine NH2-Gruppe besitzt am elektronegativen N-Atom ein freies Elektronenpaar und kann daher leicht ein Proton aufnehmen. Beim Menschen ergibt sich folgende Aufteilung:
Essentielle Aminosäuren
- Isoleucin
- Leucin
- Lysin
- Methionin
- Phenylalanin
- Threonin
- Tryptophan
- Valin
Nicht-essentielle Aminosäuren
- Alanin
- Arginin
- Asparaginsäure
- Asparagin
- Cystein
- Glutamin
- Glutaminsäure
- Glycin
- Histidin
- Prolin
- Serin
- Tyrosin (essentiell für Kinder)
Bedingt-essentielle Aminosäuren
Bedingt essentielle bzw.
Durch die Protonenaufnahme wird aus der NH2-Gruppe dann eine positiv geladenen NH3+-Gruppe:
Protonenaufnahme einer basischen Aminosäure
Autor: Ulrich Helmich 02/2024, Lizenz: Public domainWie man an dem Gleichgewichtspfeil in der Abbildung sieht, ist diese Protonenaufnahme der NH2-Gruppe reversibel, das heißt, die NH3+-Gruppe kann das Proton auch leicht wieder abgeben.
Für Profis:
Lysin und Arginin sind die beiden einzigen Aminosäuren, die tatsächlich ein basisches Verhalten zeigen.
Aminosäuren mit einem S-Atom im Rest
Die polaren Aminosäuren Cystein und Methionin
Autor: Ulrich Helmich, Lizenz: Public domainEng verwandt mit dem Serin ist das Cystein, eine äußerst wichtige Aminosäure, wie wir später noch sehen werden. Aminosäuren mit einer CONH2-Gruppe im Rest
Zwei Aminosäuren mit polaren ungeladenen Resten: Asparagin und Glutamin
Autor: Ulrich Helmich 02/2024, Lizenz: Public domainDie beiden Aminosäuren Asparagin und Glutamin sind recht interessant.
Unter dem IEP (saurer Bereich) nimmt die Aminogruppe ein Proton auf und wird so zum Kation (NH2 → NH3+). Betrachtet man eine Aminosäure in der , unterscheidet man nach dem 2 Konfigurationen:
D-Aminosäuren: die NH2- bzw.

semi-essentielle Aminosäuren sind Aminosäuren, die normalerweise nicht-essentiell sind und nur in bestimmten Situationen mit der Nahrung aufgenommen werden müssen. positiven Ladungen der Gruppen 3 und 4 wurden hier nicht mit eingezeichnet, aber man kann sich ja leicht denken, dass die COOH-Gruppen ein Proton abgeben und die NH2-Gruppen eines aufnehmen können.
Die Markierung (E) ist ein Hinweis für die Leute aus dem Fach Ernährungslehre.
Man kennt inzwischen mehr als 30 eukaryotische und mehr als 15 prokaryotische Proteine, in denen die Aminosäure Selenocystein vorkommt [6].
Die 20 biogenen Aminosäuren
Hier ein Überblick der 20 Aminosäuren, die in Lebewesen eine Rolle spielen:
Die 20 proteinogenen Aminosäuren
Autor: Ulrich Helmich, Lizenz: Public domain.Aminosäuren mit einem sauren Rest
Zwei saure Aminosäuren: Asparaginsäure und Glutaminsäure
Autor: Ulrich Helmich 02/2024, Lizenz: Public domainAuf diesem Bild sieht man die Aminosäuren Asparaginsäure und Glutaminsäure, deren Seitenketten Carboxygruppen enthalten. Also würde man die Aminosäuren Cystein und Methionin auch bei der zweiten Gruppe nach Römpp, Alberts etc.
Im engeren Sinn sind mit dem Begriff "proteinogen" meistens die 20 verschiedenen kanonischen Aminosäuren gemeint, aus denen die menschlichen Eiweiße zusammengesetzt sind. In Proteinen des menschlichen Körpers kommen nur L-Aminosäuren vor. Daher gehören diese beiden Aminosäuren zu den zwar polaren aber ungeladenen Aminosäuren. Die Aminosäuren sind in ihrer Grundstruktur immer gleich aufgebaut: aus einem zentralen Kohlenstoffatom (C), das 4 Substituenten trägt:
- Aminogruppe (-NH2)
- Carboxylgruppe (-COOH)
- Wasserstoffatom (-H)
- Rest, der für jede Aminosäure charakteristisch ist (-R)
direkt ins Video springen
Der Rest der Aminosäuren kann eine oder mehrere funktionelle Gruppen enthalten.
Man achte aber darauf, dass in den Seitenkette von Serin und Threonin keine elektrische Ladung vorkommen.